TULIPEIRA-AFRICANA
(Spathodea campanulata): MOCINHA OU VILÃ PARA
AS ABELHAS?
Ana Carolina Martins de Queiroz1, Giorgio C. Venturieri1, Felipe A. León Contrera2
1 – Embrapa Amazônia Oriental – Laboratório de Botânica. Travessa Dr. Enéas Pinheiro s/n, Caixa Postal 48, CEP 66095-100, Belém/PA, Brasil.
2 – Instituto de Ciências Biológicas, Laboratório de Biologia e Ecologia de Abelhas. Universidade Federal do Pará. Rua Augusto Corrêa, No 1, Campus Básico, Guamá, CEP 66075-110 Belém – PA, Brasil.

INTRODUÇÃO
A relação de dependência entre abelhas e plantas é inquestionável. As primeiras retiram seus recursos alimentares (néctar e pólen) das flores, enquanto as plantas têm garantido o serviço de polinização realizado pelas abelhas (e outros agentes), permitindo sua reprodução. Mas nem sempre essa relação se dá de forma harmoniosa, plantas tóxicas, por exemplo, podem trazer graves consequências para os animais que costumam visitar suas flores em busca de alimento. Essas substâncias tóxicas podem estar presentes no pólen ou néctar das flores (Roubik, 1989).
Para as abelhas, o efeito tóxico de algumas plantas é bem conhecido e estudado. O falso barbatimão, Dimorphandra mollis Benth. (Leguminosae), e o barbatimão verdadeiro, Stryphnodendron adstringens (Martius) Coville (Leguminosae) podem causar graves prejuízos aos apicultores, devido a mortalidade das larvas e redução na longevidade de adultos de Apis mellifera. O consumo tanto de pólen quanto de néctar pode causar esses efeitos, sendo o pólen considerado mais nocivo (Carvalho & Message 2004; Santoro et al. 2004; Cintra et al. 2005).
Outra planta que apresenta vários registros de efeito tóxico é a espécie Spathodea campanulata, popularmente chamada de bisnagueira, tulipa africana ou espatódea. É uma árvore de grande porte (até 20m) originária das florestas tropicais das regiões central e ocidental africanas, que tem sido largamente utilizada em vários lugares, incluindo o Brasil, para fins ornamentais, devido a presença de flores numerosas, grandes e coloridas (Francis 1990). Além do uso paisagístico, vários são os registros das propriedades medicinais dessa espécie e uso como controladores de pragas (Franco et al. 2015)
Apesar desses importantes benefícios, a espatódea foi citada na lista de “100 piores espécies invasoras do mundo” pelo Grupo de Especialistas em Espécies Invasoras (ISSG), da União Internacional para a Conservação da Natureza (IUCN). Vários países registaram prejuízos causados por essa espécie, considerando-a como invasora, incluindo Austrália, Brasil, Ilhas do Caribe (Cuba, Porto Rico, Martinica, Guadalupe) e muitas Ilhas do Pacífico incluindo Ilhas Cook, Fiji, Polinésia Francesa, Guam, Havaí, Nova Caledônia e Vanuatu (Meyer 2000).
Sobre a interação entre espatódea e abelhas, vários são os registros destes insetos mortos em flores desta planta (inclusive abelhas sem ferrão) como já descrito por Portugal-Araújo em 1963 e posteriormente por Nogueira- Neto (1970) e Oliveira et al. (1991). Estudos científicos mais atuais também analisaram essa interação. Trigo e Santos (2000) monitoraram os insetos mortos nas flores desta planta por até cinco dias após a antese e relataram que os meliponíneos representaram 97% dos insetos mortos. Calligaris (2001) confirmou em laboratório a toxicidade do néctar, embora não tenha verificado ação tóxica do pólen sobre as operárias de abelhas Scaptotrigona postica e A. mellifera. Devido a esses efeitos letais, não se recomenda o uso de S. campanulata nas proximidades dos apiários, embora seja citada como planta de importância polinífera para A. mellifera na região de Viçosa, MG (Modro et al. 2011). Neste trabalho, verificamos o efeito tóxico do néctar e pólen de espatódea sobre duas espécies de meliponíneos amazônicos, assim como investigamos se um evento de alta mortalidade de operárias na área de estudo poderia estar relacionada ao consumo de néctar e pólen dessa planta.
Material e Métodos
Espécies de abelhas e área de estudo
As espécies de abelhas utilizadas para se verificar o efeito do néctar e pólen de S. campanulata sobre a sobrevivência de operárias foram Melipona seminigra, popularmente conhecida como uruçu boca de renda, que ocorre na Amazônia brasileira, nos estados do Amazonas e Pará (Camargo & Pedro 2012) (Figura 1), e M. fasciculata, uruçu cinzenta ou tiúba, que ocorre nos Estados brasileiros do Maranhão, Mato Grosso, Pará, Piauí e Tocantins (Camargo & Pedro 2012).
Todos os experimentos foram realizados no meliponário científico da Embrapa Amazônia Oriental (1o26’11.52’’S, 48o26’35.50’’W), localizado no município de Belém, PA, Brasil, no período de janeiro a maio de 2012.
Análise de Colônias Mortas por Envenenamento
Observações feitas em janeiro de 2012 em dois ninhos de M. fasciculata e três de M. seminigra permitiram verificar que estas colônias estavam com sintomas de envenenamento provavelmente por néctar ou pólen tóxicos, sintomas que incluíam a morte de larvas e operárias adultas. Nessas colônias, as larvas morriam dentro das células operculadas, antes mesmo de se transformarem em pupa.
Em um estágio inicial, as operárias conseguiam limpar as primeiras células com sintomas, após alguns dias a mortalidade de operárias adultas também era intensa, não havendo mais a limpeza das células, atraindo forídeos, formigas e outros insetos oportunistas (Figura 2 a e b). Em algumas colônias mais fortes, as operárias conseguiam manter por mais tempo a colônia e vários discos de cria eram limpos e totalmente removidos, em alguns casos ficando somente a rainha com um pequeno grupo de operárias. Os potes de alimento permaneciam intactos até o momento da infestação pelos insetos detritívoros.
Devido à proximidade (cerca de 20 m) dos ninhos da árvore de S. campanulata, foi avaliado se esse envenenamento estaria relacionado à presença de pólen e néctar dessa espécie nos ninhos. Para isso, cerca de 2 ml de alimento larval de cinco células em estágio de ovo, provenientes de duas colônias de M. fasciculata e três de M. seminigra foram submetidos ao método da acetólise, utilizando a metodologia de Erdtman (1960), que consiste na utilização de anidrido acético e ácido sulfúrico (9:1), para eliminação do conteúdo celular do grão de pólen. O mesmo procedimento foi realizado para cinco amostras do pólen de S. campanulata colhidas de anteras fechadas ou recém-abertas em laboratório, para compor a palinoteca que será utilizada para identificação do pólen desta espécie.
Foram confeccionadas lâminas de ambos os materiais, utilizando gelatina glicerinada e parafina para selagem. As lâminas permanentes de pólen de S. campanulata foram utilizadas como referência para identificação desta espécie. Foram confeccionadas duas lâminas de alimento larval para cada amostra. De cada lâmina foram contados 200 grãos de pólen, sendo identificados os de S. campanulata por comparação com a lâmina de referência e calculado o percentual de frequência desta planta nas amostras.

Delineamento Experimental
Para analisar o efeito do néctar e pólen de S. campanulata sobre a sobrevivência de operárias de M. fasciculata e M. seminigra foram conduzidos experimentos laboratoriais utilizando-se 60 operárias recém-emergidas, coletadas de quatro diferentes ninhos de cada espécie do meliponário da Embrapa Amazônia Oriental. As operárias permaneceram confinadas em caixas de polietileno (8 x 8 x 4 cm), sem presença de rainha, e divididos em grupos de 10 indivíduos, mantidas em estufa a temperatura em torno de 28°C e a cada dia foi feita a verificação do número de abelhas.
Néctar e pólen de S. campanulata oferecido às operárias de M. fasciculata e M. seminigra, foram coletados de inflorescências contendo botões florais e flores recém-abertas em árvores localizadas no campus de pesquisa da Embrapa Amazônia Oriental em Belém, Pará. Uma amostra botânica contendo a estrutura reprodutiva da planta foi identificada e depositada no Herbário IAN sob o n° 187659.
As operárias foram submetidas à dietas:
NSc- abelhas alimentadas com néctar de S. campanulata; NeC- abelhas alimentadas com solução de sacarose a 11%; PSc- abelhas alimentadas com solução de sacarose a 11% e pólen de S. campanulata; PoC- abelhas alimentadas com solução de sacarose (controle néctar) a 11% e pólen da própria espécie
(controle pólen).
Foram feitas curvas de sobrevivência (Kaplan-Meier) para os diferentes tratamentos de cada espécie. Para comparar as curvas de sobrevivência em relação ao tratamento utilizado para cada espécie, foi aplicado o teste de Cox-Mantel, utilizando o programa STATISTICA® 8.0. Para todos os testes foram adotados nível de significância de 5%.
Resultados e Discussão
Nas colônias de M. fasciculata (n=2) e M. seminigra (n=3) com sintomas de envenenamento foi verificado um percentual variado de pólen de S. campanulata no alimento larval de cinco colônias. O pólen de S. campanulata foi encontrado em todas as lâminas (n=10), sendo que em M. fasciculata os percentuais de pólen de S. campanulata foram maiores (19,3% e 13,57%) do que os de M. seminigra (3,33%; 13,06% e 5,41%).
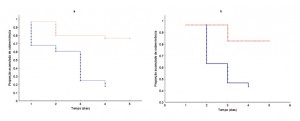
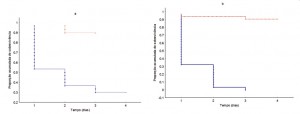
Em relação a sobrevivência, a taxa de mortalidade foi maior nas abelhas que receberam néctar de espatódea quando comparado ao grupo controle (Figura 3a), em ambas as espécies. O mesmo foi verificado em relação ao pólen, sendo que as abelhas que consumiram pólen apresentaram uma mortalidade mais elevada que as do grupo controle (Figura 3b).
Pólen tóxico pode ser uma estratégia para diminuir a perda de pólen, uma vez que grande quantidade deste é coletado pelas abelhas e utilizado na alimentação da colônia, tornando-os indisponíveis para polinização (Hargreaves et al., 2009). Neste estudo, verificamos que além do pólen, o néctar de espatódea reduziu consideravelmente a longevidade destas operárias, sendo o néctar considerado mais tóxico que o pólen. A produção de néctar tóxico serviria como um efetivo filtro de visitantes, estimulando a especialização dos polinizadores, na tentativa de impedir o roubo de néctar, na prevenção da degradação do néctar e na adulteração do comportamento de polinização (Adler 2000).
Esta pode ser a estratégia adotada por S. campanulata, uma vez que Rangaiah et al. (2004), em estudos realizados na Índia, observaram que abelhas não são polinizadoras efetivas, pois visitam apenas uma árvore e essa espécie apresenta autoincompatibilidade. Dessa forma, seria necessário que o polinizador visitasse várias árvores para promover a transferência de pólen. As abelhas mortas no interior das flores serviriam de alimento para pássaros, polinizadores exclusivos desta planta, tornando a espécie mais atrativa para aqueles. Dessa forma, o néctar ou pólen podem ter ação química que promove a mortalidade das abelhas, posteriormente utilizadas como recompensa aos polinizadores efetivos de S. campanulata, que não parecem ser afetados pelos compostos tóxicos presentes.
Além de néctar e pólen, a secreção do botão floral também pode concorrer para a mortalidade das abelhas, como apontado por Portugal-Araújo (1963), Trigo e Santos (2000) e Calligaris (2001), que verificaram o efeito tóxico dessa mucilagem sobre várias espécies de abelhas.
Considerações gerais e recomendações aos meliponicultores:
É importante alertar sobre os perigos do uso dessa espécie de planta em área a ser forrageada por abelhas sem ferrão, devido a toxicidade constatada no néctar, pólen e mucilagem do botão de S. campanulata.
Considerando a recente expansão da meliponicultura para diversos fins, inclusive a polinização de culturas agrícolas (Venturieri et al. 2012), não se recomenda o uso o uso de espatódea em áreas onde se pratica a meliponicultura.
Agradecimentos
Agradecemos à Elizangela Rego, Lourival Lucas e Miguel Nascimento pelo apoio técnico. À Fundação Amazônia Paraense de Amparo à Pesquisa (FAPESPA) e ao Conselho Nacional de Desenvolvimento Cientifico e Tecnológico (CNPq) pelo auxílio financeiro (FAPESPA ICCAF 004/2012/CNPQ 554318/2010-5), através do Projeto Bionorte.
Referências Bibliográficas
Adler, L.S. (2000). The ecological significance of toxic nectar. Oikos, 91:409-420. doi:10.1034/j.1600-0706.2000.910301.x
Calligaris, I.B. (2001). Toxicidade do néctar e do pólen de Spathodea campanulata (Bignoneaceae) sobre operárias de Apis mellifera (Hymenoptera: Apidae) e Scaptotrigona postica (Hymenoptera: Apidae). Dissertation, Universidade Estadual Paulista Júlio de Mesquita Filho
Camargo, J.M.F. & Pedro, S.R.M. (2012). Meliponini Lepeletier, 1836. In J.S. Moure, D. Urban & G.A.R. Melo (Orgs) Catalogue of Bees (Hymenoptera, Apoidea) in the Neotropical Region – online version. http://www.moure.cria.org.br/catalogue.(accessed date 27 August, 2013).
Carvalho, A.C.P. & Message, D. (2004). A scientific note on the toxic pollen of Stryphnodendron polyphyllum (Fabaceae, Mimosoideae) which causes sacbrood-like symptoms. Apidologie, 35:89-90. https://doi.org/10.1051/apido:2003059
Cintra P., Malaspina, O. & Bueno, O.C. (2005). Plantas tóxicas para abelhas. Arq. Inst. Biol., 72:547-551. Retrived from: http://www.biologico.sp.gov.br/docs/arq/v72_4/cintra.pdf
Francis, J.K. (1990). African tulip tree (Spathodea campanulata Beauv.) Res. Note SO-ITF-SM-32. http://www.fs.fed.us/global/iitf/Spathodeacampanulata.pdf. (acessed date 1 february, 2013).
Franco, D.P., Guerreiro, J.C., Ruiz, M.G., Silva, R.M.G. (2015). Evaluación del potencial insecticida del néctar de Spathodea campanulata (Bignoniaceae) sobre Sitophilus zeamais (Coleoptera: Curculionidae). Rev. Col. Entom., 41(1):63-67.
Hargreaves, A.L., Harder, L.D., Johnson, S.D. (2009). Consumptive emasculation: the ecological and evolutionary consequences of pollen theft. Biol. Rev., 84:259–276. doi:10.1111/j.1469-185X.2008.00074.x
Modro, A.F.H., Message, D., Luz, C.F.P., Meira-Neto, J.A.A.(2011). Flora de importância polinífera para Apis mellifera (L.) na região de Viçosa, MG. Rev. Árvore, 35: 1145-1153. doi:10.1590/S0100-67622011000600020.14
Nogueira-Neto, P. (1997). Vida e criação de abelhas indígenas sem ferrão. São Paulo: Ed. Nogueirapis,446p.
Oliveira, R.M., Giannotti, E., Machado, V.L.L. (1991). Visitantes florais de Spathodea campanulata Beauv. (Bignoniaceae). Bioikos, 5:7-30.
Portugal-Araújo, V. (1963). O perigo de dispersão da tulipeira do gabão (Spathodea campanulata Beauv.). Chácaras e quintais, 107: 562.
Rangaiah, K., Rao, P.S., Raju, A.J.S. (2004). Bird-pollination and fruiting phenology in Spathodea campanulata Beauv. (Bignoniaceae). Beitr. Biol. Pflanz., 73(3):395-408.
Roubik, D.W. (1989) Ecology and Natural History of Tropical Bees. New York: Cambridge University Press.
Santoro, K.R., Vieira, M.E.Q., Queiroz, M.L., Queiroz, M.C. & Barbosa, S.B.P. (2004). Efeito do tanino de Stryphnodendron spp. sobre a longevidade de abelhas Apis mellifera L. Arch. Zootec., 53:281-291.Retrieved from: http://www.redalyc.org/pdf/495/49520305.pdf
Trigo, J.R. & Santos, W.F. (2000). Insect mortality in Spathodea campanulata Beauv. (Bignoniaceae) flowers. Rev. Bras. Biol., 60:537-8. Retrieved from: http://dx.doi.org/10.1590/S0034-71082000000300019
Venturieri, G.C., Alves, D.A., Villas-Boas, J.K., Carvalho, C.A.L., Menezes, C., Vollet-Neto, A., Contrera, F.A.L., Cortopassi-Laurino, M., Nogueira-Neto, P. & Imperatriz-Fonseca, V.L. (2012). Meliponicultura no Brasil: situação atual e perspectivas futuras para uso na polinização agrícola. In: V.L. Imperatriz-Fonseca, D.A.L. Canhos, D.A. Alves & A.M. Saraiva (Orgs.)., Contribuição e perspectivas para a biodiversidade, uso sustentável, conservação e serviços ambientais (pp.213-236). São Paulo: Edusp.

