Própolis pode ser um aliado para lidar com a covid-19 ?
Dra. Andresa Aparecida Berretta1 & Marcelo Augusto Duarte Silveira2
1 Farmacêutica-Bioquímica, mestre, doutora e pós-doutora pela Faculdade de Ciências Farmacêuticas de Ribeirão Preto, Universidade de São Paulo, com foco de atuação em própolis. Responsável Técnica e Gerente de Pesquisa, Desenvolvimento e Inovação na Apis Flora Indl. Coml. Ltda., Presidente da ABEMEL (2020-2021) e sócia-fundadora da Agrobee;
2 Médico pela Universidade Estadual de Ciências da Saúde de Alagoas. Especialista em Clínica Medica (Hospital Santa Marcelina, SP), especialista em Nefrologia pela USP/SP. Doutor em nefrologia pela USP/SP. médico pesquisador do Instituto D’or de Pesquisa. Membro da Diretoria de Fisiologia e Fisiopatologia Renal da Sociedade Brasileira de Nefrologia-SBN (Biênio 2019-2020).
No final de 2019, um novo coronavírus foi identificado como a causa de um conjunto de casos de pneumonia em Wuhan, uma cidade na província de Hubei, na China. Ele se espalhou rapidamente, resultando em uma epidemia em toda a China, seguida por um número crescente de casos em outros países do mundo. Em fevereiro de 2020, a Organização Mundial da Saúde designou a doença COVID-19, que significa doença de coronavírus 2019 [1]. O vírus que causa a COVID-19 é designado por coronavírus 2 da síndrome respiratória aguda grave (SARS-CoV-2) (1).
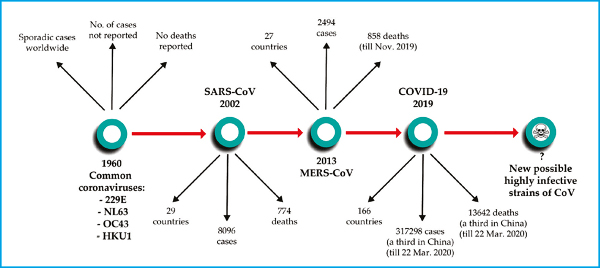
Em meados do final de março de 2020, mais de 460 mil casos de COVID-19 foram constatados ao redor do mundo. Acredita-se que o período de incubação da COVID-19 esteja dentro de 14 dias após a exposição, com a maioria dos casos ocorrendo aproximadamente quatro a cinco dias após a exposição (2,3,4). Uma vez infectado, pode haver disseminação viral de 10-37 dias do início dos sintomas (5).
Este é o terceiro grande surto de coronavírus nos últimos 20 anos que teve impacto socioeconômico substancial, mas o primeiro no século 21 a afetar países de todos os continentes, exceto a Antártica. O pânico geral e a insegurança expressos em todos os níveis sociopolíticos e econômicos perturbaram dramaticamente a vida cotidiana, as viagens e o comércio internacional. Não obstante às graves interrupções no estilo de vida, a doença associada à depressão foi relatada devido a medidas extremas de isolamento (12).
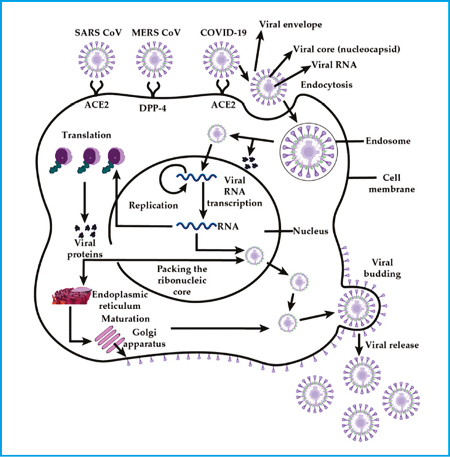
receptor da enzima conversora de angiotensina II (ACE2) (13,14) , embora algumas
cepas também usem outros receptores alternativos, como o CD209L, pelos quais
eles têm uma afinidade mais baixa (15) . Extraído de Docea et al. 2020 (12) .
O espectro da infecção sintomática varia de leve a crítico, sendo que a maioria das infecções não é grave (4-9). Os dados clínicos que envolvem os primeiros relatos com casuísticas maiores denotam para um acometimento de quadros graves com insuficiência respiratória em até 5% dos casos; estes necessitam de internação em unidade de terapia intensiva (UTI) (5-9). Os dados de pacientes críticos podem variar de uma região para a outra, mas essencialmente, a mortalidade provocada pela doença está mais associada a grupos de risco como: idosos, portadores de diabetes, doenças cardíacas e pulmonares crônicas, portadores de neoplasias (10, 11). Os principais sintomas reportados envolvem febre, tosse, dispneia, confusão, dor muscular, dor de cabeça, dor de garganta, rinorreia, dor no peito, diarreia, náusea, vômito, anosmia (perda de olfato) e disgeusia (distorção ou perda de paladar) (12).
O genoma dos coronavírus contém genes para as quatro proteínas estruturais: envelope (E), membrana (M), nucleocapsídeo (N) e espiga (S). Seu ácido nucleico genômico consiste em um RNA positivo de cadeia simples, que requer um ciclo de replicação de RNA negativo intermediário que gera RNAs codificadores de proteínas subgenômicas, bem como RNA genômico para formação de outros vírus. As glicoproteínas dos coronavírus mediam a ligação, a fusão e a entrada nas células hospedeiras, mas diferentes partes dessas glicoproteínas estão envolvidas em cada um desses processos. Alterações conformacionais da glicoproteína e proteólise da catepsina L nos endossomos também estão envolvidas na patogênese do coronavírus (12).

O receptor primário usado pelos coronavírus para entrar nas células-alvo é o receptor da enzima conversora de angiotensina II (ACE2) (13,14), embora algumas cepas também usem outros receptores alternativos, como o CD209L, pelos quais eles têm uma afinidade mais baixa (15).
O desenvolvimento de pneumonia atípica com rápida deterioração respiratória e falha determinada pela infecção por coronavírus está associado ao aumento dos níveis de quimiocinas e citocinas pró-inflamatórias ativadas (16). Um papel importante é desempenhado pela amplitude da imunidade do hospedeiro; por exemplo, os níveis de interferon canônico terminam a síntese proteica ou até induzem a morte celular. No entanto, a intensidade da resposta imune pode variar, dependendo de outras comorbidades do paciente, explicando o papel delas na evolução da doença (12). Prevê-se que a taxa de mortalidade seja mais alta em pacientes imunocomprometidos, mas isso não está estabelecido até o momento. Por outro lado, parece que a reação imune exacerbada na infecção por Covid-19 é a que leva ao maior dano pulmonar e sistêmico (12).
Própolis

A própolis é uma substância resinosa obtida pelas abelhas a partir de exsudatos vegetais (17). Há centenas de anos a própolis vem sendo usada em função das suas propriedades biológicas. Já foram descritas várias atividades para a própolis, dentre essas: antiviral, antibacteriana, anti-inflamatória, imunomoduladora, antioxidante, inibidora da angiotensina 2 (ECA2), além de muitas outras (18,19,20,21,27).
A própolis é totalmente dependente da origem botânica, espécie de abelha e região geográfica, e com isso, no Brasil, treze tipos diferentes já foram descritos (23). Em função dessa grande variabilidade, Berretta et al. (2012) desenvolveram um Extrato de Própolis Padronizado, denominado EPP-AF® (PI 0405483-0, Revista de Propriedade Industrial n. 1778, 01/02/2005), que possui padronização quanto aos compostos fenólicos e flavonoides totais, além de um fingerprint característico e reprodutível lote-a-lote que contempla os compostos ácido cafeico, ácido p-cumárico, cinâmico, aromadendrina, isosakuranetina e artepelin C, além da padronização quanto à atividade biológica (24, 25). Estudos de segurança em modelos não-clínicos foram efetuados em vários modelos, incluindo em teste de Ames, micronúcleos in vitro e in vivo (dados ainda não publicados), além da segurança em modelo agudo e crônico (26).

O Extrato de Própolis Padronizado (EPP-AF®) passou por vários ensaios de atividade biológica tendo demonstrado sua eficácia e dosagens eficazes em modelos para atividade antimicrobiana frente a cepas de microrganismos gram positivos e gram negativos (24), atividade anti-Candida frente a várias cepas (29). De maior relevância para a COVID-19 foram os resultados obtidos em modelo animal de atividade imunoreguladora e anti-inflamatória (25), onde os resultados mostraram o efeito da própolis na redução da produção das citocinas inflamatórias IL-6 e TNF-alfa, e aumento da citocina reguladora IL-10. Resultados obtidos em culturas de macrófagos também demonstraram que a própolis inibe a produção de IL-1 beta, via importante do inflamassoma, em doenças como artrite reumatoide, lúpus e outras doenças autoimunes, dados que validam nossa hipótese de que o uso da própolis nos pacientes acometidos pela COVID-19 podem ter seus sintomas e efeitos minimizados.
Estudo de segurança clínico com o Extrato de Própolis Padronizado (EPP-AF®) na dose diária de 375 mg/dia foi realizado com voluntários, sem evento adverso observado. Além disso, estudo para avaliação de interação medicamentosa foi realizado através do uso de “cocktail” para análise das principais enzimas metabolizadoras hepáticas (CYPs) e para a enzima de transporte PgP. Os resultados mostraram que o uso do Extrato de Própolis Padronizado (EPP-AF®) é seguro e sem risco de interação medicamentosa conforme os critérios estabelecidos pela OMS (27). Note que a própolis testada no estudo de interação foi em cápsulas/comprimidos, ou seja, esses resultados não podem ser necessariamente extrapolados para as versões alcólicas.

Estudo clínico randomizado duplo-cego placebo controlado em 32 pacientes portadores de Doença Renal Crônica, demonstrou segurança do Extrato de Própolis Padronizado (EPP-AF®) na dose de 500mg/dia após a administração por 12 meses, tendo demonstrado redução significativa de Proteinúria e MCP1 urinário no Grupo Própolis comparado com o Placebo 695 [95% CI, 483 to 999] vs. 1403 [95% CI, 1031 to 1909] mg/24h; p=0,004 e 58 [95% CI, 36 to 95] vs. 98 [62 to 155] pg/mg uCr); p=0.038, respectivamente (26). Outro estudo clínico realizado com o do Extrato de Própolis Padronizado (EPP-AF®) em voluntários sadios teve como objetivo a avaliação da atividade antioxidante. Os resultados foram surpreendentes e mostraram a redução do dano celular induzido por estresse oxidativo em voluntários sadios através do aumento da capacidade antioxidante enzimática, principalmente para a superóxido dismutase (SOD) (artigo submetido). Esses dados indicam o importante efeito protetor que a própolis tem nas células, tecidos e em todo o ser humano, evitando o envelhecimento, doenças degenerativas e vários outros processos que envolvem esses processos de oxidação.
Segurança
A própolis já é utilizada como alimento, suplemento alimentar e outros fins terapêuticos há décadas e tem se mostrado segura independente de faixa etária, sexo e presença de comorbidades como câncer e diabetes mellitus. Resultados obtidos com o Extrato de Própolis Padronizado (EPP-AF®) demonstraram, através de vários modelos experimentais e clínicos que, o Extrato de Própolis Padronizado (EPP-AF®) não apresenta potencial ou dano citotóxico ou genético através do teste de Ames e ensaios de micronúcleos in vitro e in vivo. Estudos agudos e crônicos já foram realizados com o Extrato de Própolis Padronizado (EPP-AF®) em animais como camundongos, ratos Wistar e coelhos, tendo demonstrado segurança. Até a dosagem de 3000 mg/kg não houve mortalidade dos animais. Estudos crônicos com coelhos e ratos Wistar utilizaram dosagens de 300 mg/kg e 1000 mg/kg, respectivamente, tendo demonstrado segurança (dados em fase de publicação).

Além dos estudos de segurança já citados acima, um estudo clínico de segurança foi realizado na Faculdade de Medicina de Ribeirão Preto, Universidade de São Paulo (FMRP/USP) com voluntários sadios a fim de se avaliar a segurança da ingestão de 375 mg/dia de Extrato de Própolis Padronizado (EPP-AF®), por 5 dias. Os resultados demonstraram que nenhum evento adverso foi observado. O estudo apontou para a ausência de toxicidade aguda seguida do uso oral do Extrato de Própolis Padronizado (EPP-AF®) na dose de 375 mg diários por um período de uso de 5 dias. A variação positiva estatisticamente significativa observada no parâmetro HDL colesterol necessita de estudos futuros com um maior número de pacientes para se confirmar este efeito benéfico ao sistema cardiovascular.
Além dos resultados de segurança já demonstrados, também foi realizado um importante protocolo clínico para avaliação da potencial interação do Extrato de Própolis Padronizado (EPP-AF®) com outros medicamentos metabolizados pelas principais enzimas hepáticas CYPs e pela enzima de transporte PgP, e os resultados mostraram que a própolis é segura e não interage significativamente, conforme protocolo da Organização Mundial de Saúde (OMS) e, desse modo, o risco de interação da própolis é praticamente ou inexistente (Cusinato et al. 2019).
Dosagens
De posse de todos os estudos clínicos já realizados pela equipe de Pesquisa, Desenvolvimento e Inovação da Apis Flora Indl. Coml. Ltda, e com base na sua linha de produtos padronizados, é possível sugerir com segurança, dosagens efetivas de 375 – 500 mg de própolis/dia. O que seria equivalente à 30 gotas, 3 a 4 vezes ao dia, diluídas em água, ou 3 a 4 cápsulas de Propomax® cápsulas/dia. Para fins preventivos visando aumento da imunidade, usualmente 30 gotas/dia ou 1 cápsula, são usualmente eficientes para essa finalidade.
Conclusão
Em suma, a COVID-19 é uma infecção causada pelo vírus SARS-CoV-2, que acomete o organismo através da entrada pelas mucosas orais, nasais, oculares, e infecta as células através do acesso às mesmas pelo receptor de acetilcolinesterase-2 (ACE2 ou ECA-2), e outras vias em estudo. A infecção afeta principalmente o sistema respiratório, com danos graves consequentes à um burst de citocinas inflamatórias. A população de risco envolve idosos e pacientes já acometidos por outras morbidades como hipertensão, diabetes, câncer, dentre outras.
A própolis, por sua vez, demonstra importantes efeitos anti-inflamatórios e imunoreguladores, que por si só já justificam seu uso como preventivo e coadjuvante em tratamentos de processos infecciosos e inflamatórios.
A atividade antiviral da própolis também já foi relatada para DNA e RNA vírus (poliovírus, herpes simplex vírus-HSV, HSV aciclovir resistente, adenovírus) em modelos in vitro. Evidentemente, ainda não existem estudos da própolis frente ao vírus SARS-CoV-2, no entanto, muito provavelmente, em breve esses estudos serão realizados. Não obstante o seu potencial para aumento da imunidade e consequente prevenção da infecção pelo vírus, e o importante efeito anti-inflamatório capaz de potencialmente minimizar os efeitos dos pacientes acometidos pela COVID-19, estudos com a ACE demonstraram a inibição de 75% da mesma pela própolis, sendo mais uma potencial forma para reduzir a invasão do vírus. Além das atividades acima expostas, é relevante informar que a própolis não interage com as principais enzimas hepáticas (CYPs) e com a enzima de transporte PgP, conforme critérios adotados pela Organização Mundial da Saúde e, deste modo, a própolis pode ser utilizada concomitantemente com os principais medicamentos sem qualquer risco, tanto de potencialização quanto inativação (Cusinato et al. 2019).
Se a própolis especificamente atua no SARS-CoV-2, só o tempo e os resultados científicos irão mostrar, mas é seguro dizer que a própolis é um produto que não oferece risco, exceto pelos alérgicos, evidentemente, e que as atividades biológicas já demonstradas pela mesma na literatura científica internacional, tem fundamentação para a sugestão do uso potencial da mesma para prevenção e como um coadjuvante no tratamento.
Referências Bibliográficas
1. World Health Organization. Novel Coronavirus (2019-nCoV) technical guidance. https://www.who.int/emergencies/diseases/novel-coronavirus-2019/technical-guidance (Accessed on March 25, 2020).
2. Li Q, Guan X, Wu P, et.al. Early Transmission Dynamics in Wuhan, China, of Novel Coronavirus-Infected Pneumonia. N Engl J Med. 2020.
3. Guan WJ, Ni ZY, Hu Y, et.al. Clinical Characteristics of Coronavirus Disease 2019 in China. N Engl J Med. 2020;
4. Chan JF, Yuan S, Kok KH. A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person-to-person transmission: a study of a family cluster. Lancet. 2020;395(10223):514.
5. Huang C, Wang Y, Li X, et. al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China.Lancet. 2020;395(10223):497.
6. Chen N, Zhou M, Dong X, et. Al. Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study. Lancet. 2020;395(10223):507. Epub 2020 Jan 30.
7. Wang D, Hu B, Hu C, et.al. Clinical Characteristics of 138 Hospitalized Patients With 2019 Novel Coronavirus-Infected Pneumonia in Wuhan, China.JAMA. 2020.
8. Liu K, Fang YY, Deng Y, et.al. Clinical characteristics of novel coronavirus cases in tertiary hospitals in Hubei Province. Chin Med J (Engl). 2020.
9. Yang X, Yu Y, Xu J, et.al. Clinical course and outcomes of critically ill patients with SARS-CoV-2 pneumonia in Wuhan, China: a single-centered, retrospective, observational study. Lancet Respir Med. 2020.
10. Zhou F, Yu T, Du R. Clinical course and risk factors for mortality of adult inpatients with COVID-19 in Wuhan, China: a retrospective cohort study. Lancet. 2020.
11. Wu Z, McGoogan JM. Characteristics of and Important Lessons From the Coronavirus Disease 2019 (COVID-19) Outbreak in China: Summary of a Report of 72 314 Cases From the Chinese Center for Disease Control and Prevention. JAMA. 2020.
12. Docea A.O, Tsatsakis A, et al. A new threat from an old enemy: Re-emergence of coronavirus (Review). International Journal of Molecular Medicine. 45:1631-1643,2020.
13. Zhou P, Yang XL, Wang XG, Hu B, Zhang L, Zhang W, Si HR, Zhu Y, Li B, Huang cL, et al: A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature 579: 270-273, 2020.
14. Hoffmann M, Kleine-Weber H, Schroeder S, et al: SARS-coV-2 cell Entry depends on AcE2 and TMPRSS2 and Is Blocked by a clinically Proven Protease Inhibitor Article SARS-coV-2 cell Entry depends on AcE2 and TMPRSS2 and Is Blocked by a clinically Proven Protease Inhibitor. cell 181: 1-10, 2020.
15. Jeffers SA, Tusell SM, Gillim-Ross L, et al: cd209L (L-SIGN) is a receptor for severe acute respiratory syndrome coronavirus. Proc Natl Acad Sci USA 101: 15748-15753, 2004.
16. Ding Y, He L, Zhang Q, et al: Organ distribution of severe acute respiratory syndrome (SARS) associated coronavirus (SARS-CoV) in SARS patients: implications for pathogenesis and virus transmission pathways. J Pathol 203: 622-630, 2004.
19. Park YK, Koo MH, Ikegaki M, Cury JA, Rosalen PL, Abreu JAS. Antimicrobial properties of propolis on oral microorganisms. Current Microbiology 36:24-28, 1998.
20. Park YK, Alencar SM, Aguiar CL. Botanical origin and chemical composition of Brazilian propolis. Journal of Agricultural and Food Chemistry 50:2502-2506, 2002.
21. Park YK, Ikegaki M, Alencar SM, Moura FF. Evaluation of Brazilian propolis by both physicochemical methods and biological activity. Honeybe Science 21:85-90, 2000.
22. Alencar SM, Oldoni TLC, Castro ML, Cabral ISR, Costa-Neto CM, Cury JA, Rosalen PL, Ikegaki M. Chemical Composition and Botanical Origin of Red Propolis, a New Type of Brazilian Propolis. Journal of Ethnopharmacology 2007.
23. Khayyal MT, Elghazaly MA, Elkhatib AS. Mechanisms involved in the anti-inflammatory effect of propolis extract. Drugs Under Experimental and Clinical Research. 19:197-203, 1993.
24. Berretta, AA, Nascimento AP, et. al. Propolis Standardized Extract (EPP-AF®), an Innovative Chemically and Biologically Reproducible Pharmaceutical Compound for Treating Wounds. International Journal of Biological Sciences 2012; 8(4):512-521.
25. Machado JL, Assunção AK, et.al. Brazilian Green Propolis: Anti-Inflammatory Property by an Immunomodulatory Activity. Evid Based Complement Alternat Med. 2012;2012:157652.
26. Reis CMF, Carvalho JCT, Caputo LRG, Patricio KCM, Barbosa MVJ, Chieff AL, Bastos J K, 2000. Atividade antiinflamatória, antiúlcera gástrica e toxicidade subcrônica do extrato etanólico de própolis., Rev Bras Farmacogn 9-10 (1), 43-52.
27. Cusinato DAC, Martinez EZ, Cintra MTC, Figueira GCO, Berretta AA, Lanchote VL, Coelho EB. Evaluation of potential herbal-drug interactions of a standardized propolis extract (EPP-AF®) using an in vivo cocktail approach. Journal of Ethnopharmacology, 2019, 245, 112174.
28. Silveira MAD, Teles F, Berretta AA, et.al. Effects of Brazilian Green Propolis on Proteinuria and Renal Function in Patients with Chronic Kidney Disease. A Randomized, Double-Blind, Placebo-Controlled Trial. BMC Nephrol. 2019 Apr 25;20(1):140.
29. Amoros M, Sauvager F, Girre L, Cormier M. In vitro antiviral activity of propolis. Apidologie. 1992, 23, 231-240.

