PRÓPOLIS E GEOPRÓPOLIS DO SEMIÁRIDO DERIVADAS DE JUREMA-PRETA
Joselena Mendonça Ferreira1, Caroline C. Fernandes-Silva2, Giuseppina Negri3, Kátia Peres Gramacho1, Ramiro Gustavo Valera Camacho4, Emília Cristina Pereira de Arruda5, Dejair Message1, Antonio Salatino2
– 1Universidade Federal Rural do Semi-Árido, Departamento de Ciências Animais, Mossoró, RN, Brasil.
– 2Universidade de São Paulo, Instituto de Biociências, São Paulo, SP, Brasil.
– 3Universidade Federal de São Paulo, São Paulo, SP, Brasil.
– 4Universidade do Estado do Rio Grande do Norte, Departamento de Ciências Biológicas, Mossoró, RN, Brasil.
– 5Universidade Federal de Pernambuco, Centro de Ciências Biológicas, Departamento de Botânica, Recife, PE, Brasil.
INTRODUÇÃO

de Afonso Bezerra, região de Semiárido, estado do Rio Grande do Norte, nordeste do Brasil.
Foto: Joselena M. Ferreira.
Própolis é um produto apícola elaborado com resinas coletadas por abelhas, de partes vegetativas das plantas ou exsudados resinosos. Na colônia é usada como barreira física e química, para fechar frestas existentes no ninho e manter a assepsia da colmeia (Berretta et al., 2017, Righi et al., 2013). Contém resina, cera de abelha, substâncias voláteis e outros componentes minoritários (Salatino et al., 2011).
Esse produto é utilizado desde 1700 a. C. pelo povo egípcio, que usavam a própolis no embalsamamento de cadáveres. Ela também foi utilizada nos períodos de guerras, para a cicatrização de ferimentos (Pereira et al., 2002). No Brasil, o interesse pela própolis aconteceu somente na década de 1980, quando Ernesto Ulrich Breyer, demonstrou suas propriedades terapêuticas (Lima, 2006). Desde então, vêm sendo reportados muitos estudos sobre a composição química e atividade biológica da própolis (Tazawa et al., 2016), incluindo trabalhos que se dedicaram a isolar substâncias de interesse terapêutico (Li et al., 2010; Tazawa et al., 2016) e estudar as fontes de resina que dão origem aos seus diferentes tipos (Salatino et al., 2011).
A própolis é disponibilizada no comércio na forma de cápsulas, extratos (hidroalcoólico ou glicólico), enxaguatório bucal, em pó, entre outras. Na medicina tradicional, é usada para o tratamento de mau hálito (halitose), eczema, infecções da garganta, úlceras e infecções urinárias (Pereira et al., 2002). Além disso, é empregada na indústria alimentícia na forma de alimentos funcionais e na veterinária para cicatrizar feridas (Alencar et al., 2005). Na indústria de cosméticos, faz parte da composição de cremes de beleza, pasta dental, xampus e sabonetes (Costa; Oliveira, 2005).
As técnicas mais frequentemente utilizadas para a análise e quantificação dos constituintes químicos da própolis são a cromatografia gasosa (CG) e a cromatografia líquida de alta eficiência (HPLC), ambas acopladas à espectroscopia de massas (Bankova et al., 2016). Através dessa técnica, Aga et al. (1994) identificaram três compostos majoritários na própolis verde do sudeste do Brasil: o ácido 3,5-diprenil-4-hidroxicinâmico (Artepilina C), e seus derivados, os ácidos 3-prenil-4-hidroxicinâmico e 2,2-dimetil-6-carboxietenil-2H-l-benzopirano.
A determinação da origem geográfica e, principalmente, da fonte vegetal são de extrema importância no controle de qualidade e na padronização das amostras de própolis (Bankova et al., 2016). Segundo Belmiro et al. (2011), no Brasil existem mais de dez subtipos de própolis de Apis mellifera, incluindo as própolis verde, vermelha, marrom, preta, amarela e as geoprópolis (produzidas por abelhas nativas), que são diferenciadas pela cor, odor e consistência. Muitos pesquisadores demonstraram a similaridade de algumas substâncias naturais de ocorrência nas plantas com componentes encontrados na própolis. A composição química da própolis verde do sudeste do Brasil assemelha-se à composição da resina de Baccharis dracunculifolia, indicando que esta espécie vegetal é a fonte de resina daquela própolis (Teixeira et al., 2005).
NOVA PRÓPOLIS VERDE DO SEMIÁRIDO
Recentemente, foi encontrado um tipo novo de própolis verde nos municípios de Afonso Bezerra e Alto do Rodrigues, estado do Rio Grande do Norte (RN), região do Semiárido, Nordeste do Brasil. O perfil químico da própolis do RN, é diferente daquele obtido com a própolis verde do Sudeste do Brasil. A própolis do Sudeste, é rica em fenilpropanóides prenilados e ácidos cafeoilquínicos (Salatino et al., 2011), enquanto a própolis verde do Nordeste, contém predominantemente flavonoides metoxilados e chalconas (Ferreira et al., 2017a). A composição química desta própolis do Semiárido, quando comparada com o extrato de Mimosa tenuiflora, indicou esta espécie como fonte da resina da própolis.
A vegetação da Caatinga no Nordeste apresenta grande potencial botânico, porém pouco explorado quanto ao conhecimento da composição química e do potencial terapêutico de sua flora. Mimosa tenuiflora (Wild) Poiret, conhecida popularmente por “jurema-preta”, é uma leguminosa da subfamília Mimosoideae. É uma espécie arbórea de porte pequeno e copa irregular, que pode atingir até sete metros de altura. Típica de semiárido brasileiro, é apreciada pelo seu potencial forrageiro e propriedades medicinais, sendo utilizada no tratamento de ferimentos, acne e queimaduras na pele. A casca da jurema-preta é utilizada para o preparo do “vinho-de-jurema”, uma bebida utilizada em rituais enteógenos derivados de tradições indígenas e africanas.
Essa espécie possui rápido crescimento, sistema radicular profundo e pode florescer durante todo o ano, tanto na estação seca como na chuvosa, se destacando por sua abundância e disseminação no Nordeste Brasileiro (Gariglio et al., 2010), motivo pelo qual é importante fonte de pólen para a nutrição das abelhas.
Um tipo novo de própolis verde foi coletado nos municípios de Afonso Bezerra (5º 29’ 45.7” S; 36º 31’ 10.3” W) e Alto do Rodrigues (5º 15′ 21′′S; 36º 45′ 29′′ W). Os apiários de coleta destas própolis estão inseridos em área de floresta de Caatinga, a qual é predominante no local, e contém uma infestação de algarobas (Prosopis juliflora) em seu entorno. Esta planta é de origem asiática e foi introduzida na região para fins alimentícios do gado, ovinos e caprinos. Na região também é evidente a ação antrópica, a qual inclui áreas de plantações de melão. Durante todo o período experimental não foi fornecido nenhum tipo de alimentação artificial para as colônias.
Um sistema de sarrafos foi utilizado para estimular a produção da própolis. Neste sistema, foi escolhido duas barras de madeira com dimensões de 370 x 20 x 20 mm. Uma delas foi colocada na parte frontal e outra na traseira da colmeia, entre o ninho e a melgueira, criando um espaço de 20 mm nas duas laterais. A coleta da própolis foi feita cortando e removendo somente a própolis depositada pelas abelhas na abertura de 20 mm nas duas laterais entre o ninho e a melgueira (Fig. 1), não sendo removida a própolis adicionada em outras partes das colmeias.

A seguir, as amostras foram pesadas e homogeneizadas, após remoção de partes estranhas incluídas durante o manejo, como pedaços de madeira, parte de abelhas, etc. Ápices da espécie Mimosa tenuiflora também foram coletados. Extratos etanólicos foram preparados com as amostras de própolis para realização da quantificação dos teores totais de fenóis, flavonoides, ceras e sólidos solúveis. A preparação do extrato etanólico foi feita em extrator Soxhlet com 10 g da própolis pulverizada, coletada de cada município (Afonso Bezerra e Alto do Rodrigues) e aproximadamente 150 mL de álcool etílico absoluto (PA), durante 6 horas. A seguir, as amostras foram filtradas em papel de filtro Whatman nº 1 e armazenadas em frascos âmbar em freezer. A cera dos extratos foi eliminada três vezes consecutivas por meio de resfriamento e filtração, com posterior dissolução do resíduo em 5 ml de etanol. Os extratos foram concentrados em rotaevaporador. As análises químicas foram realizadas no Laboratório de Fitoquímica, Departamento de Botânica, Universidade de São Paulo. Os dados de massa seca, teores de fenóis e flavonoides totais, teor de cera, e atividades antioxidantes foram realizados de acordo com os métodos descritos por Fernandes-Silva et al. (2013). Os ápices de Mimosa tenuiflora (1 g) foram extraídos com 50 mL de etanol durante 6 horas em Soxhlet. Em seguida, o solvente foi eliminado sob pressão reduzida e o extrato bruto foi pesado.
As amostras de própolis coletadas no RN mostraram teores similares de fenóis totais, flavonoides totais e sólidos solúveis (Tabela 2). A própolis proveniente do município de Alto do Rodrigues apresentou os maiores percentuais de fenóis totais e sólidos solúveis, exceto em relação ao teor flavonoides totais.
Os percentuais de componentes fenólicos dessas amostras são considerados altos, de acordo com o RTIQP (Brasil, 2001), bem acima do ideal para comercialização, segundo a legislação. Esses compostos fenólicos são conhecidos como agentes antioxidantes, capazes de reduzir a quantidade de radicais livres (através da oxidação) nos processos biológicos dos seres vivos. Foram utilizados os seguintes testes: 1) sistema β-caroteno/ácido linoleico; 2) método de sequestro de radicais livres DPPH. Os resultados obtidos pelos dois métodos ressaltam a similaridade entre os perfis fitoquímicos das duas amostras de própolis, como é mostrado na Tabela 3.

Geoprópolis do Semiárido
Geoprópolis é um produto feito por abelhas sem ferrão. Ele é semelhante à própolis das abelhas do gênero Apis, uma vez que ambos os produtos contêm resina vegetal e cera de abelha. Essas duas são distintas, no entanto, porque a geoprópolis contém conteúdo variável de material de solo agregados a resina (Araújo et al., 2015). Entretanto, alguns tipos de resinas de abelhas nativas podem ser considerados simplesmente como “própolis” devido a mínima ou inexistente quantidade de partículas de solo que é depositada juntamente com a resina.
Um novo tipo de geoprópolis foi coletada em Mossoró, região do semiárido (Ferreira et al., 2017b). Essa geoprópolis chamou a atenção devido a sua similaridade aparente (resinosa maleável/verde escuro) com a própolis produzida pelas abelhas Apis mellifera (abelhas africanizadas) da mesma região. A abelha coletora da geopropolis foi identificada como Scaptotrigona aff. depilis pelo Dr. Airton Torres Carvalho (Universidade Federal Rural de Pernambuco, UFRPE). Essa amostra foi coletada no meliponário da Fazenda Experimental Rafael Fernandes, Universidade Federal Rural do Semi-Árido (UFERSA), no município de Mossoró, (05° 11’ 16” S 37° 20’ 38” O), Rio Grande do Norte, em janeiro de 2014.

Embora as amostras de própolis verde tenham apresentado uma similaridade maior com a composição química do extrato etanólico da jurema-preta, a geoprópolis provavelmente também tem essa espécie como fonte de resina. Esse resultado explica-se pelo fato de as abelhas coletarem mais de uma fonte de resina para produção de própolis. A pequena variação entre o perfil químico pode ter ocorrido devido às diferentes áreas onde foram obtidas as amostras. Quando comparado à coleta de resina por abelhas Apis mellifera, pode ser observado que as abelhas nativas restringem a sua coleta de resina aos arredores da colmeia (Velikova et al., 2000). Essa pode ter sido uma explicação para a variação de conteúdo entre as amostras.
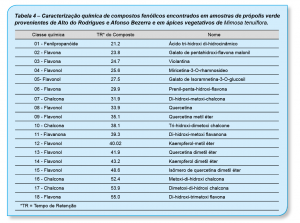
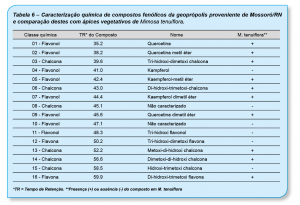
Os principais constituintes detectados na geoprópolis foram os flavonóis 1, 2, 7 e 9, a flavona 16 e as chalconas 6, 13 e 14 os quais foram detectados nas amostras de própolis verde e ápices de Mimosa tenuiflora (Tab. 4 e 6). O perfil químico das própolis e da geoprópolis verde indicam que Mimosa tenuiflora é a fonte principal de resina dessas amostras coletadas no estado do Rio Grande do Norte (Ferreira et al., 2017a, b).
No entanto, na geoprópolis foram encontrados o flavonol kaempferol e a hidroxi-trimetoxi chalcona, os quais não foram detectados nas amostras de própolis e da jurema-preta. Esse fato sugere que outras espécies de plantas podem ter sido coletadas pelas abelhas nativas para a elaboração da geoprópolis do município de Mossoró/RN. É interessante notar que, apesar da diferença entre as espécies de abelhas e os locais de coleta das amostras, a atividade antioxidante, os teores de fenóis e flavonoides totais e os perfis químicos foram similares entre a própolis e a geoprópolis elaboradas pelas abelhas Apis mellifera e Scaptotrigona aff. depilis, respectivamente, no estado do Rio Grande do Norte.
CONSIDERAÇÕES FINAIS
Esses resultados demonstram que a própolis e a geoprópolis verde do estado do Rio Grande do Norte, no semiárido brasileiro, possuem potencial promissor em termos de qualidade e percentual de substâncias com atividade biológica, podendo ser comercializada segundo a regulamentação vigente. Embora a própolis e a geoprópolis diferiram em alguns componentes químicos, a maioria dos componentes encontrados em ambas também foram encontrados em M. tenuiflora podendo esta fonte botânica ser apontada como sua origem primária. Este estudo pode contribuir para melhor conhecimento e exploração do potencial na apicultura e meliponicultura na região de semiárido nordestino, que visem incentivo e crescimento da economia local, bem como preservação da sua flora, composta por plantas nativas como a “jurema-preta”.
AGRADECIMENTOS
Os pesquisadores agradecem a colaboração do apicultor Aldifran Medeiros, o apoio concedido pelo Núcleo de Capacitação Tecnológica em Apicultura do Rio Grande do Norte (NCTA/UFERSA) e o amparo financeiro prestado pela Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) e pela Fundação de Amparo à Pesquisa do Estado de São Paulo (FAPESP), para a realização desta pesquisa.
REFERÊNCIAS
AGA, H.; SHIBUYA, T.; SUGIMOTO, T.; KURIMOTO, M.; NAKAJIMA, S. Isolation and identification of antimicrobial compounds in Brazilian propolis. Bioscience, Biotechnology, and Biochemistry, v. 58, n. 5, p. 945-946, 1994.
ARAÚJO, M. J. A. M.; BÚFALO, M. C.; CONTI, B. J. et al., Thechemical composition and pharmacological activities of geopropolis produced by Melipona fasciculata Smith in northeast Brazil, Journal of Molecular Pathophysiology, v. 4, n. 1, p. 12–20, 2015.
BANKOVA, VASSYA; BERTELLI, D.; BORBA, R. ET AL. Standard methods for Apis mellifera propolis research. Journal of Apicultural Research, p. 1-49, 2016. DOI:10.1080/00218839.2016.1222661
BELMIRO, M. S.; OKI, Y.; FERNANDES, G. W. Própolis: Nosso tesouro, Revista Mensagem doce, n.112, 2011. Disponível em: https://www.apacame.org.br/mensagemdoce/112/artigo2.htm. Acesso realizado em: 16/01/19.
BERRETTA, A. A.; ARRUDA, C.; MIGUEL, F. G.; et al. Functional Properties of Brazilian Propolis: From Chemical Composition Until the Market. Agricultural and Biological Sciences. In: SHIOMI, N. (ed.). Superfood and Functional Food – An Overview of Their Processing and Utilization. InTech, p.55-97, 2017. DOI: 10.5772/65932.
BRASIL. Ministério da Agricultura, Pecuária e Abastecimento. Portaria nº 3, de 19/01/2001, Instrução Normativa Nº 3, de 19 de Janeiro de 2001.
COSTA, P.S.C.; OLIVEIRA, J.S. Manual Prático de Criação de Abelhas. Viçosa: Editora Aprenda Fácil, 2005, 424p.
FERNANDES-SILVA, C. C.; SALATINO, A.; SALATINO, M. L. F.; BREYER, E. D. H.; NEGRI, G. Chemical profiling of six samples of Brazilian própolis. Química Nova, v. 36, n. 2, p. 237-240, 2013.
FERREIRA, J. M.; FERNANDES-SILVA, C. C.; SALATINO, A.; NEGRI, G.; MESSAGE, D. New propolis type from northeast Brazil: chemical composition, antioxidant activity and botanical origin. Journal of the Science of food and Agriculture, v. 97, n. 11, p. 3552-3558, 2017a.
FERREIRA, J. M.; FERNANDES-SILVA, C. C; SALATINO, A.; MESSAGE, D.; NEGRI, G. Antioxidant activity of a geopropolis from northeast Brazil: chemical characterization and likely botanical origin. Evidence-Based Complementary and Alternative Medicine, 2017b, Article ID 4024721.DOI: 10.1155/2017/4024721.
GARIGLIO, M. A.; SAMPAIO, E.V. S. B.; CESTARO, L. A.; KAGEYAMA, P.Y. Uso sustentável e conservação dos recursos florestais da Caatinga. Brasília: Serviço Florestal Brasileiro, 2010, 368p.
LIMA, M. G. A produção de própolis no Brasil. São João da Boa Vista: São Sebastião Editora e Gráfica, 2006.
PEREIRA, A. S.; SEIXAS, F. R. M. S.; AQUINO NETO, F. R. Própolis: 100 anos de pesquisa e suas perspectivas futuras. Química Nova, v. 25, p. 321-326, 2002.
RIGHI, A. A.; NEGRI, G., SALATINO, A. Comparative chemistry of propolis from eight Brazilian localities. Evidence-Based Complementary and Alternative Medicine, p.1-14, 2013: article ID-267878. DOI: 10.1155/2013/267878.
SALATINO, A.; FERNANDES-SILVA, C.C.; RIGHI, A.A.; SALATINO, M.L.F. Propolis research and the chemistry of plant products. Natural Product Report, v. 28, n.5, p. 925–936, 2011.
TAZAWA, S.; ARAI, Y.; HOTTA, S.; MITSUI, T.; NOZAKI, T.; ICHIHANA, K. Discovery of a Novel Diterpene in Brown Propolis from the State of Parana, Brazil. Natural Product Communications, v. 11, n. 2, p. 201-205, 2016.
VELIKOVA, M.; BANKOVA, V.; MARCUCCI, M. C. et al. Chemical composition and biological activity of propolis from Brazilian meliponinae. Zeitschrift für Naturforschung C, v. 55, n. 9-10, p. 785-789, 2000

