Aethina tumida Murray (Coleoptera, nitidulidae), o pequeno besouro das colmeias, chega ao Brasil
Érica Weinstein Teixeira1, David de Jong2, Aroni SAttler3, Dejair Message4
1 Laboratório de Sanidade Apícola (LASA), Pólo Regional do Vale do Paraíba, Agência Paulista de Tecnologia dos Agronegócios – APTA –SAA. Av. Professor Manoel César Ribeiro, 320, CP 07, 12.400-970. Pindamonhangaba, SP, Brasil.
2 Departamento de Genética, Faculdade de Medicina de Ribeirão Preto (FMRP), Universidade de São Paulo (USP). Av. Bandeirantes, 3900. 14.049-900 Ribeirão Preto, SP, Brasil.
3 Departamento de Fitossanidade, Faculdade de Agronomia, Universidade Federal do Rio Grande do Sul (UFRGS), Av. Bento Gonçalves 7712. 91540-000 Porto Alegre, RS, Brasil.
4 Departamento de Ciências Animais, Universidade Federal Rural do Semi-Árido (UFERSA), Km 47-BR110 Mossoró, RN, Brazil. – Correspondência: E. W. Teixeira, erica@apta.sp.gov.br – Imagens com direitos reservados às fontes de origem.
Em 26 de fevereiro de 2016 o Ministério de Agricultura e Abastecimento oficializou, junto à Organização Mundial para Saúde Animal (OIE*), a presença do pequeno besouro das colmeias, o Aethina tumida, em território nacional. Todavia, segundo relatório emitido pelos Órgãos Oficiais, a primeira constatação da presença do besouro em apiário brasileiro data de cerca de um ano antes. Este fato é preocupante, considerando o tempo transcorrido entre a observação do besouro em colmeias em Piracicaba-SP e o início das investigações visando medidas que previnam a dispersão e promovam o controle e/ou erradicação do agente.
Nos Estados Unidos aconteceu de forma semelhante: um apicultor constatou a presença do besouro em colmeia na Carolina do Norte (formada a partir de captura de enxame da natureza), cuja amostra foi parcialmente identificada por taxonomista na Universidade de Clemson no mesmo Estado (na ocasião, a identificação ocorreu apenas até família e não até espécie) e, dois anos depois, em 1998, a praga foi encontrada em apiário comercial da Flórida que foi por ela dizimado. Confirmou-se a espécie previamente identificada na Carolina do Norte e considera-se esta a primeira notícia do besouro fora de território africano, de onde o besouro é originário.
Esta nota técnica tem por objetivo alertar a classe produtora (a principal afetada pelos possíveis danos causados por esta praga das colmeias) quanto aos aspectos biológicos desse inseto e como o apicultor, o meliponicultor e o cidadão em geral devem proceder em caso de suspeita. Os detalhes aqui relatados visam também subsidiar e auxiliar os profissionais do Serviço Oficial de Defesa Agropecuária do Brasil a entenderem como é a relação desse inseto praga com as abelhas, esclarecendo aspectos da biologia do besouro, dentro dos limites até então já estudados e conhecidos. Não pretende-se apresentar uma revisão no sentido estrito do termo, mas sim discorrer sobre aspectos que auxiliem na mitigação da dispersão da praga invasora. A literatura utilizada encontra-se ao final do manuscrito e pode ser consultada para maiores detalhes.

Por que é importante informar, mesmo que se trate apenas de suspeita do besouro ou de qualquer outro agente estranho à colmeia?
A preservação da saúde de animais e plantas de um determinado país depende da participação não apenas de Órgãos Oficiais (vide lista ao final do texto), mas também da sociedade como um todo. Nesse sentido, o apicultor, mesmo que não tenha certeza de que agente se trata, deve informar. Ele é parte integrante do que se chama de vigilância passiva, segundo a visão da Defesa Agropecuária.

Aethina tumida,o pequeno besouro das colmeias (do inglês “Small Hive Beetle SHB”), foi identificado pela primeira vez em amostras oriundas da África, no ano de 1867. Posteriormente ele foi encontrado nos Estados Unidos (1996) e, subsequentemente, em outros países como no Egito, na Austrália, no Canadá, no México, na Itália e na América Central (considerando os relatos ocorridos em Cuba em Melipona beecheii), além de Portugal (onde foi rapidamente erradicado).
O SHB pertence à família Nitidulidae, que também tem muitos outros representantes no Brasil (não se sabe exatamente quantas espécies, mas sabe-se que alguns apresentam relações próximas com outros Hymenopteras sociais, como formigas e cupins). Daí a importância de, em caso de suspeita da presença deste inseto nas colmeias, haver a correta identificação por especialistas. Porém, o apicultor e os cidadãos em geral, são capazes de identificar algumas características facilmente visíveis a olho nu, devendo sempre que suspeitar da presença dessa praga das colmeias, ainda que se trate apenas de suspeita, procurar coletá-lo, acondicionando-o em frasco limpo e bem fechado contendo álcool 70% (até cobrir os besouros e/ou larvas) ou mesmo colocar o frasco em congelador, sem álcool, para viabilizar posterior confirmação (vide fotos nos itens que seguem). Assim que possível a Defesa deve ser acionada.
A capacidade de deslocamento ampla (fala-se em até 13 km, mas não é possível precisar), associada à diversidade alimentar e sobrevivência em diferentes climas, são os principais fatores que permitem a esses besouros sucesso adaptativo e dispersão em diversos ambientes, motivo pelo qual a espécie vem sendo cada vez mais estudada, tanto em virtude de aspectos econômicos (devido aos prejuízos que causa) como dos aspectos biológicos (há muito ainda a se entender sobre a sua biologia).
Os diferentes substratos que o Aethina tumida pode utilizar para se alimentar (incluindo frutas) facilita sua dispersão em diversos ambientes, já que consegue sobreviver provisoriamente desta forma, ou até mesmo sem alimento por cerca de 5 dias. O ciclo reprodutivo, no entanto, até onde se sabe, ocorre apenas em colônias de abelhas, onde há disponibilidade de alimento e ambiente adequados ao desenvolvimento da fase larval do besouro. Eles também são capazes de sobreviver em clima mais frio. Por exemplo, no Canadá, há evidências de que os besouros adultos conseguem atravessar todo o período de inverno bastante rigoroso, reaparecendo na primavera, aptos a reiniciar a sua reprodução nas colmeias. Na colmeia eles se protegem das baixas temperaturas externas provavelmente ficando no aglomerado de abelhas em torno da área de cria que conseguem manter a temperatura em torno de 34ºC.

É importante salientar que as infestações do besouro em colmeias fracas podem levar ao abandono das mesmas e com isso o sucesso reprodutivo dele está garantido, pois não terão as abelhas para incomodá-los e terão alimento disponível como pólen e mel, além de crias de abelhas que ali restarem. Portanto, é importante ter em conta que o objetivo do besouro nas colmeias não é o de parasitar diretamente as abelhas, mas buscar alimento já que os produtos servem de alimento para ele (alguns autores o consideram um cleptoparasita, pois roubam alimento de outros animais e fazem disso um modo de vida).
Quando adultos, os besouros A. tumida são geralmente de cor marrom escuro a pretos, sendo muitas vezes mais claros logo após emergirem (vão escurecendo com a gradual esclerotização, ou endurecimento, do exoesqueleto). O tamanho varia dependendo da qualidade da alimentação recebida durante o seu desenvolvimento, mas geralmente medem um terço do tamanho da abelha A. mellifera (Figura 1).
De forma geral, besouros da família Nitidulidae utilizam como substrato material orgânico diverso, como frutas em decomposição, geralmente danificadas por aves ou outros animais, ou simplesmente muito maduras e até carcaças de animais. Algumas espécies se alimentam também de frutos sadios, são vetores de leveduras e são consideradas pragas de frutos.
O A. tumida, especificamente, é considerado uma praga em colmeias de abelhas. Eles possuem aguçada capacidade olfativa e são atraídos para as colmeias ou colônias naturais pelo cheiro (compostos voláteis), onde se alimentam de pólen, mel e crias, motivo pelo qual destroem favos com alimento ou crias e fazem uma “verdadeira bagunça”, desorganizando todo o enxame e causando fermentação do mel, devido à presença de leveduras a eles associadas. Muitas vezes é possível ver o mel fermentado escorrendo pelas laterais ou pelo alvado das colmeias afetadas conforme Figura 2. O cheiro é bem característico e perceptível.

Um fato interessante é que compostos voláteis presentes no feromônio de alarme das abelhas também são produzidos pelas leveduras e acredita-se que está aí parte da explicação do porque os besouros são atraídos pelos enxames de abelhas e da relação próxima que os dois insetos apresentam, chegando ao ponto das abelhas alimentarem os besouros, regurgitando ao serem tocadas em suas mandíbulas pelas antenas do besouro, muito embora tais relações ainda não sejam completamente compreendidas. Estudos comprovaram também a possibilidade de besouros adultos atacarem abelhas operárias jovens, que recém emergiram e que, portanto, apresentam exoesqueleto menos enrijecido. Acredita-se que essa estratégia seja adotada principalmente em virtude da necessidade das fêmeas do besouro apresentarem considerável necessidade de fonte proteica, já que o desenvolvimento de seus ovários demanda dieta proteica de qualidade (Figura 3).

Sabe-se que o besouro tem origem na África e que as consequências da presença dele para a atividade apícola naquele continente não são tão graves quanto às verificadas no continente Norte Americano, estando mais relacionada aos prejuízos causados ao mel contido nos favos estocado em salas de extração, antes de serem centrifugados (onde as abelhas estão ausentes para efetuar defesa). Nesses ambientes temperatura e umidade são adequadas à proliferação da praga.
Nos EUA a orientação é que se faça a extração do mel o quanto antes (1-3 dias), devido à possibilidade de ovos eclodirem, se presentes. Assim, se os quadros de mel forem deixados por mais tempo sem que sejam centrifugados, ovos dos besouros (eventualmente já presentes nos favos) podem eclodir e as larvas irão destruir os opérculos mecanicamente, além de ocorrer consumo e, principalmente, fermentação do mel. Nos EUA, quando a infestação está presente, é possível ver centenas de larvas dos besouros se arrastando sobre o chão de salas de mel, em busca de solo para empuparem (já que essa fase ocorre no solo, conforme será visto em detalhes a seguir). Há recomendação de manutenção de umidade abaixo de 50% no local onde o mel encontrase estocado, previamente à extração, assim ocorre ressecamento de ovos, se eventualmente presentes (Figura 4).
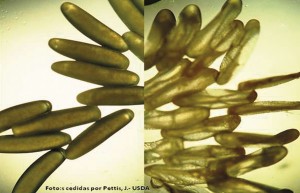
Depois da extração do mel, os favos contendo resíduos de mel também atraem os besouros. É recomendável protegê-los, colocando rapidamente as melgueiras com quadros já centrifugados sobre as colmeias, ou deixando-as expostos para que as abelhas façam a pilhagem do mel dos favos, limpando-os. O perigo desta última opção é que em termos sanitários essa técnica é sempre um risco de dispersão de outras doenças como aquelas transmitidas por bactérias, por exemplo.
Outra constatação importante é que quando as colmeias de abelhas são alimentadas com dietas proteicas, é importante que as abelhas tenham como cobrir e proteger a dieta, porque estas pastas proteicas são bastante atrativas para os besouros, cujas larvas desenvolvem rapidamente neste meio.
Devemos nos preocupar com a presença do A. tumida no Brasil?
Sim, pois a infestação pode trazer consideráveis prejuízos econômicos para a atividade apícola devido à sua ação destrutiva nas colmeias e também em favos estocados, previamente à extração do mel. Além disso, pode invadir ninhos de espécies não-Apis (há relatos de infestação em ninhos de Mellipona beecheii em Cuba e testes feitos com Bombus também evidenciaram esta possibilidade).
Embora não saibamos sobre como as abelhas A. mellifera africanizadas irão se comportar diante deste novo intruso, sabemos que, por ter origem na África e por estar em contato com as abelhas africanas há milhões de anos, ocorreram certas adaptações nesta convivência.
É importante ressaltar que as abelhas africanizadas são mais propolizadoras do que as subespécies europeias e este é um importante mecanismo de defesa, como já se tem conhecimento. As abelhas constroem pequenas barreiras com própolis, na tentativa de encurralar os besouros e muitas vezes aprisioná-los, estratégia eficiente, dependendo da intensidade da infestação e da capacidade propolizadora da colônia. As abelhas africanizadas também apresentam o comportamento higiênico mais eficaz do que as europeias (podendo atuar na limpeza de ovos e larvas do invasor). Todavia, não podemos esquecer que as abelhas africanizadas são híbridos e, portanto, uma mistura de subespécies europeias e africana, além do fato de estarem sendo expostas a esta praga apenas recentemente, pelo menos até onde se sabe. Preocupa-nos muito as colmeias de regiões onde os apicultores tem costume de introduzir rainhas europeias em suas colmeias. Apesar de serem mais dóceis para se trabalhar, estas colônias são menos resistentes a diferentes doenças e, provavelmente, também serão em relação à Aethina tumida.
Assim, toda atenção é pouca quanto ao combate desta praga, principalmente por estarmos em um país tropical, com disponibilidade de substrato apreciado pelo besouro (frutas) e, principalmente, pela preocupação com relação às abelhas não-Apis, as quais apresentam capacidade de defesa mais limitada, embora variável de acordo com a espécie. Se pensarmos que os besouros são atraídos pelo odor de fermentação, podemos imaginar que compostos que emanam de colônias de Meliponas e Trigonas exercerão tal atração. Há, ainda, relatos de colônias de Bombus infestadas experimentalmente.
Como é o ciclo de vida do A. tumida?
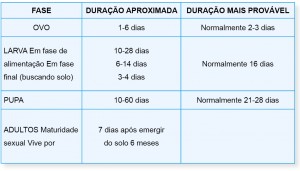
1 Adaptado de Annand, N. (In: Primefact 764, NSW DPI. Governo da Austrália).
2 Variações se devem às diferenças na alimentação e condições climáticas.
O A. tumida passa pelo processo de metamorfose completa, que compreende as fases de ovo, de larva e de pupa, até se transformar em inseto adulto (Tabela 1).
Essas transformações ocorrem parte dentro da colmeia e parte fora da colmeia (Figura 5).
Alguns aspectos do comportamento reprodutivo da espécie ainda não estão muito claros, incluindo detalhes como o número de vezes que a fêmea pode ser copulada. Porém, muitos outros aspectos já são conhecidos e já se sabe que o acasalamento pode ocorrer dentro ou fora da colmeia.

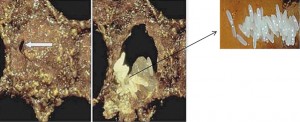
As fêmeas do besouro, após copuladas, fazem postura no interior da colmeia (cerca de 1.000 a 2.000 ovos/fêmea), sendo perceptíveis pequenos aglomerados de ovos, em caso de infestações elevadas. Estas aglomerações podem estar em frestas ou nas molduras dos quadros e também em alvéolos contendo pólen ou crias. Nesse caso é possível perceber opérculos de crias parcialmente perfurados e ao abrir encontramos os ovos, que são de formato muito parecido com os ovos das abelhas (elipsoide), porém com dois terços do tamanho. Com ovipositor fino e flexível a fêmea do besouro consegue colocar seus ovos em frestas com certa facilidade, e o faz visando protegê-los do comportamento higiênico das abelhas. O tamanho aproximado do ovo é entre 1 e 1,4mm de comprimento e 0,26mm de largura e a cor é branco-perolada, conforme pode ser visto no detalhe da (Figura 6). Há relatos de oviposição em crias operculadas também pela parede da célula vazia adjacente, não havendo, portanto perfuração do opérculo. O ovo eclode em 1-6 dias (normalmente 2-3 dias) dando origem a larvas que se alimentam de pólen, de mel e de crias, desorganizando completamente o enxame de abelhas.
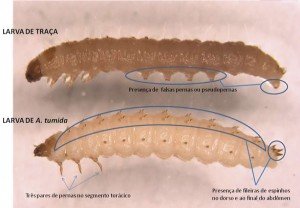
As larvas do besouro apresentam fileiras de espinhos no dorso (nas costas) e não possuem pseudopernas ou falsas pernas nos segmentos abdominais, sendo estas duas importantes características morfológicas que as diferenciam das larvas das traças. Possuem também três pares de pernas torácicas (Figura 7). Larvas maduras de A. tumida medem cerca de 1cm (podendo variar dependendo da nutrição recebida) e a coloração varia de esbranquiçadas a creme. Já o tamanho das larvas das traças que atacam a cera varia não apenas dependendo da idade, mas também da espécie. Existem duas espécies de traças, a maior é a Galleria mellonella e, a menor, é a Achroia grisella, cuja larva chega a 2cm quando madura.
A fase destrutiva do ciclo de vida do besouro A. tumida em relação aos enxames de abelhas é a fase larval conforme pode ser observado na Figura 8.
Com cerca de 13 dias, ao final da fase de alimentação da larva do A. tumida, as larvas maduras caem no solo, onde permanecem por cerca de 3 dias e se enterram no solo, próximo às colmeias e tornam-se pupas a cerca de 10cm de profundidade (120cm), ficando neste estágio em tais câmaras de pupação por cerca de 21-28 dias (diferentemente da traça, que passa pela fase de pupa dentro da colmeia).

A profundidade da câmara de pupação do besouro no solo varia dependendo do tipo de solo e, portanto, da maior ou menor facilidade que a larva de A. tumida encontra para penetrar no solo, podendo haver certo deslocamento dessa larva madura, antes da pupação, em relação à distância da colmeia – geralmente se afasta cerca de 18 a 20cm da colmeia mas há relatos de 50m de deslocamento, em virtude da rigidez do solo. A cor da pupa varia com a idade, indo de branca a marrom clara à medida que vai sofrendo esclerotização (Figura 9), com o avanço da idade da mesma e, ao se transformar em adulto, o imago ou besouro que acaba de emergir apresenta cor marrom clara.
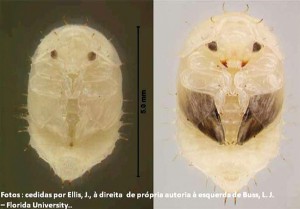
Quando emergem, os besouros adultos (Figura 10) procuram por local que os abrigue e forneça alimento, como colmeias de abelhas. As fêmeas, que geralmente são mais pesadas e um pouco mais longas do que os machos, são mais abundantes na colmeia e, depois de fecundadas, buscam por locais para fazer a postura, começando novo ciclo (Figura 5).
Na figura 11 é possível observar o tamanho da larva madura, da pupa e do besouro adulto.
Como estar vigilante e monitorando suas colmeias

Conforme apresentado, algumas características morfológicas do A. tumida podem ser relativamente fáceis de serem identificadas e auxiliam os apicultores e o cidadão em geral a agirem como verdadeiros sentinelas, sempre atentos. Mesmo que suspeitando da presença do inseto, é importante coletá-lo, entrando em contato imediato com a Defesa Agropecuária (vide lista ao final), para que esta efetue envio para correta identificação (no Brasil, até o momento, especialistas do Instituto Biológico/APTA, SAA-SP fazem a identificação por meio de características morfológicas).
Além da inspeção visual cuidadosa nos favos, área de cria, fundo, frestas, laterais da colmeia etc., o apicultor pode utilizar alguns tipos de armadilhas colocadas no fundo da colmeia, apenas para saber se o besouro está presente ou não.

Diversos tipos de armadilhas têm sido adotados nos EUA, mas o modelo mais simples é o confeccionado de plástico do tipo corrugado, ou polionda, que pode ser adquirido no mercado e cortado em tiras medindo 75x500mm (com orifícios de 4mm) (Figura 12).
Nessas armadilhas, os besouros adultos entram nos pequenos “túneis” do corrugado, em busca de proteção e abrigo, ficando fora do alcance das abelhas (lembrando que a medida inferior do espaço abelha é 6mm, o seja, orifícios maiores do que esta medida podem permitir a entrada das abelhas). Essas armadilhas podem ser feitas de plástico por serem reutilizáveis, mas papelão corrugado também serve, embora demande proteção da superfície superior e inferior com fita adesiva ou outro material que a proteja das abelhas, pois facilmente roem o papelão. Em ambos os casos as armadilhas são colocadas no fundo da colmeia. O tamanho sugerido se ajusta perfeitamente ao comprimento do fundo da colmeia que é de 60cm, podendo ser colocadas e retiradas pelo alvado para verificação a cada 24-72 horas.

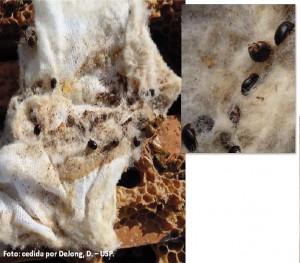
Outra opção é colocar um pedaço de pano (aproximadamente 15x15cm) sobre os quadros (Figura 13). Embora a opção do pano sobre os quadros tenha se mostrado positiva nos EUA, uma vez que os besouros ficam presos e as abelhas conseguem se libertar desfiando o tecido com a mandíbula, no Brasil, esta opção só é recomendável em colmeias fracas. Testes recentemente feitos em apiários experimentais da APTA e da USP mostraram que em colmeias fortes, as abelhas africanizadas conseguem destruir o pano por completo e, muitas vezes, jogar os restos remanescentes para fora da colmeia. O tipo de tecido utilizado nos EUA é semelhante ao que se utiliza no Brasil em cozinhas (pano de pia reutilizável). Todavia, com as abelhas africanizadas, modelos mais espessos e passíveis de serem desfiados pelas abelhas são mais recomendáveis. Nesses testes feitos no Brasil não foi possível testar a eficiência do pano na captura dos besouros, apenas na capacidade de desfiar das abelhas, já que em tais locais o besouro não está presente.
Como minimizar a presença do besouro nas colmeias?
Mantendo as colônias fortes e selecionando-as para comportamento higiênico, já que aumentam as chances de eliminação de ovos e larvas por parte das abelhas.
Colônias fracas não conseguem se defender da infestação do besouro, que geralmente ocorre por meio de propolização (construindo espécies de barreiras) ou por meio de comportamento higiênico, efetuando a retirada dos ovos e das larvas.
Assim, deve ser adotado manejo adequado, no sentido de manter rainhas jovens, com boa postura, de forma a permitir renovação satisfatória da população, para que bom efetivo de abelhas adultas possa atuar nessas ações de combate ao invasor.
A renovação de quadros velhos por novos ajuda, não apenas no espaço para postura de uma rainha prolífica, como também na eliminação de quadros mais velhos que contenham pólen estocado em excesso e velho (não mais consumido pelas abelhas) mas que serve de fonte proteica para as fases imaturas do besouro, além das crias que também servem de fonte proteica para o invasor. Assim, sem adequada ingestão proteica a reprodução do besouro pode entrar em declínio.
Outro fator relevante a ser evitado é a manipulação excessiva e desnecessária das colônias, uma vez que se configura em fator de estresse e vulnerabilidade.
As recomendações básicas de local de instalação de apiários também auxiliam sobremaneira nessa prevenção, uma vez que a pupação do besouro é facilitada em solos úmidos e moles ou pouco rígidos.
Evitar introduzir colônias capturadas na natureza imediatamente em apiários de produção. O risco sanitário é grande. Não apenas nesse caso, mas também quando se utiliza alimentação suplementar proteica com pólen de origem desconhecida ou quando se adquire colmeias povoadas de origem desconhecida. Atenção também deve ser dada às vestimentas apícolas utilizadas em diferentes apiários, aos utensílios comuns como formões, fumigadores, além de troca de quadros entre colônias, podendo esta ser uma forma de contribuir com a dispersão.
ADAPI. Governo do Piauí. Vigilância Epidemiológica: Objetivos. www.adapi.pi.gov.br/vigilancia-epidemiologica/objetivos. Acesso em 16/03/16.
Agroscope-Pests. http://www.agroscope.admin.ch/imkerei/00316/00327/index.html?lang=en. Acesso em 16/03/16.
Annad, N. 2006. NSW-DPI. Small hive beetle management options. Prime Facts 764.
https://www.dpi.nsw.gov.au/__data/assets/pdf_file/0010/220240/small-hive-beetlemanagement-options.pdf Acesso em 16/03/16.
ANSES Sophia Antipolis (France), FERA (United Kingdom), FLI (Germany), IZSVe (Italy). Small hive beetle. Versão February 2015. file:///C:/Users/DEPTO/Downloads/EURL_SHB.pdf. Acesso 16/03/16.
Benda, N. D., Boucias, D., Torto, B., Teal, P. 2008. Detection and characterization of KAdamaea ohmeri associated with small hive beetle Aethina tumida infesting honey bee hives. Journal of Apicultural Research and Bee World, 47, p. 194-201.
Fernandes, D. R. R., Bená, D. C., Lara, R. I. R., Ide, S., Perioto, N. W. 2012. Nitidulidae (Coleoptera) associados a frutos de café (Coffea arabica L.). Coffe Science, 7, p. 135-138.
Hood, M. Small hive beetle IPM. Clemsom University. http://www.clemson.edu/psapublishing/Pages/Entom/EB160.pdf. Acesso em 16/03/16.
Lundie, A. E. 1940. The small hive beetle Aethina tumida. Scientific Bulletin 220. Dep. Agric. Forestry, Gov. Printer. Pretoria. South Africa.
Neumann, P., Elzen, P. J. 2004. The biology of the small hive beetle Aethina tumida, Coleoptera: Nitidulidae): Gaps in our knowledge of an invasive species. Apidologie, 35, p. 229-247.
Neumann, P., Evans, J., Pettis, J., Pirk, C. W. W., Schafer, M. O., Tanner, G., Ellis, J. D.. 2013. Standard methods for small hive beetle. Journal of Apicultural Research, 52, 32p.
OIE. 2013. Small Hive Beetle Infestation (Aethina tumida). In: Manual of Diagnostic Tests and Vaccines for Terrestrial Animals 2013. Chapter 2.2.5. 6p.
Peña, W. L., Carallo, L. F., Lorenzo, J. D. 2014. Reporte de Aethina tumida Murray (Coleoptera: Nitidulidae) en colonias de la abeja sin aguijón Melipona beecheii Bennett de Matanzas e Mayabec. Comunicación Corta. Revista de Salud Animal, 36, p. 201 – 204.
Pettis, J., Shimanuki, H. 2000. Observations on the Small Hive Beetle, Aethina tumida Murray, in the United States. American Bee Journal, February, p. 152-155.
Pirk, C. W. W., Neumann, P. 2013. Small hive beetle are facultative predators of adult honey bees. Journal of Insect Behavior, 26, p. 796-803. DOI 10.1007/s10905-013-93926.
Schafer, M. O., Pettis, J., Ritter, W., Neumann, P. 2008. A scientific note on quantitative diagnosis of small hive beetles, Aethina tumida, in the field. Apidologie, 39, p. 564-565.
Schmolke, M. D. 1974. A study of Aethina tumida: the small Hive Beetle. Project Report. University of Rhodesia, p. 178.
University of Florida. Feature Criatures – Entomology and Nematology. Aethina tumida Murray (Insecta: Coleoptera: Nitidulidae). http://entnemdept.ufl.edu/creatures/misc/bees/small_hive_beetle.htm. Acesso em 16/03/16.


