DESENVOLVIMENTO LARVAL DE Apis mellifera SUBMETIDAS A DIFERENTES POSIÇÕES DE CÚPULAS PARA PRODUÇÃO DE RAINHAS
Felipe Jackson de Farias Silva1, Erika Bruna de Araújo Silva1, Marianna Suellen Bispo Viera1, Katia Nunes de Farias1, Ana Maria Torres de Paula1, Leandro Douglas Silva Santos1, Carolyny Batista Lima1, Adriana Aparecida Pereira1
1 Universidade Federal de Alagoas, campus Arapiraca
felipe.jackson2@gmail.com; erikabruna.as@gmail.com; mariisuellenvieira@gmail.com; nf_kattia@hotmail.com; anamariatorres97@gmail.com; cblzte@hotmail.com; adri_zoo@hotmail.com
RESUMO
Objetivou-se com o presente estudo avaliar o desenvolvimento larval de Apis mellifera submetidas a diferentes posições de cúpulas para produção de rainhas. O experimento foi realizado no Setor de Apicultura da Universidade Federal de Alagoas, Campus Arapiraca, localizado no município de Arapiraca – AL. Inicialmente ofertou-se alimentação estimulante para simular um período alto fluxo de néctar. Após esse período, foram retiradas larvas de uma colmeia matriz, para realização da enxertia em cúpulas de cera e posterior inserção destas em uma colmeia recria para verificar a facilidade de aceitação. O delineamento utilizado foi o inteiramente casualizado com 3 tratamentos (T1=cúpulas posicionadas para baixo; T2=cúpulas voltadas para cima e T3= cúpulas posicionadas horizontalmente) e 10 repetições cada.A rejeição de 100% em 72 horas ocorreu tanto para o quadro inserido na colmeia recria com adição de geleia real da própria colmeia quanto com geleia artificial.Não foi possível avaliar as características morfológicas das abelhas rainhas recém-nascidas Apis mellifera nas diferentes posições de cúpula devido ao alto índice de mortalidade das larvas, sendo necessário novas pesquisas.
Palavras-chave: Apicultura, Produção de rainha, Realeira.
INTRODUÇÃO e OBJETIVOS

A apicultura é uma atividade que depende de diversos fatores para seu desenvolvimento (PEREIRA et al., 2006), desde a disponibilidade de recursos naturais até a qualidade genética e produtiva das rainhas. Nesse aspecto, deve-se considerar que a rainha sofre acentuado desgaste ao longo de sua vida reprodutiva, especialmente em regiões tropicais, devendo ser substituída regularmente, a fim de manter a produção da colmeia elevada (BOAVENTURA E SANTOS, 2006).

O processo de criação artificial de rainhas iniciou-se na Grécia antiga e, sendo constantemente melhorado, tornou-se corriqueiro e amplamente realizado por grandes produtores, que podem produzir rainhas para atender suas próprias necessidades ou fazê-lo para venda a outros apicultores (BÜCHLER et al., 2013). No entanto, destaca WIESE (2005), a maioria dos pequenos apicultores não realiza a substituição controlada das rainhas, deixando que esta ocorra naturalmente, quando a rainha morre ou encontra-se com baixo estoque de espermatozoides em sua espermateca, o que afeta a produção e favorece a enxameação.
Vários fatores podem influenciar na qualidade das rainhas, como a idade da larva utilizada, a quantidade de geleia real ofertada, as condições gerais da colmeia em que foi produzida, o tamanho e posição da realeira, dentre outros (ALBARRACÍN et al, 2006).
Assim, objetivou-se, com este trabalho, avaliar o efeito de diferentes posições de cúpulas sobre o desenvolvimento das larvas de Apis mellifera.
METODOLOGIA
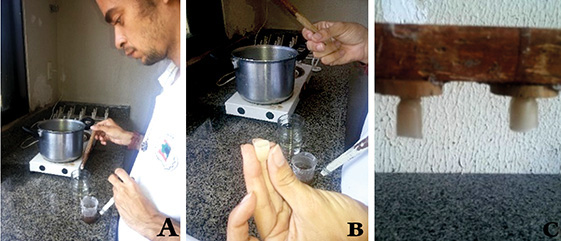
O experimento ocorreu,no Setor de Apicultura da Universidade Federal de Alagoas, Campus Arapiraca, localizado no município de Arapiraca-AL. Inicialmente, foi ofertada alimentação pastosa estimulante a base de pólen, proteína de soja, açúcar mascavo e água, para simular um período de intenso fluxo alimentar, a fim de fortalecer os enxames, para posterior seleção e divisão da colmeia mais forte, e coleta de larvas de 1 a 3 dia de vida segundo metodologia de DOOLITTLE(1889). (Figura 1).
Passados 30 dias do início da alimentação das colmeias, a mais forte foi selecionada e dividida. Após 4 dias da divisão foram retiradas da colmeia recria (órfã), as realeiras puxadas para extração da geleia real e um quadro com crias de 1 a 3 dias de vida da colmeia matriz (Figura 2).
No intervalo entre a alimentação e a divisão da colmeia foram confeccionadas e fixadas 30 cúpulas de cera de aproximadamente 10 mm de diâmetro e 12 mm de altura,em um barrote de madeira fixado em um único quadro porta cúpulas, nas diferentes posições (T1=10 cúpulas posicionadas para cima; T2=10 cúpulas posicionadas horizontalmente e T3= 10 cúpulas voltadas para baixo). Foi confeccionado também um quadro com cúpulas posicionadas somente para baixo, introduzido na colmeia recria durante o período de alimentação, afim da colmeia matriz se adaptar ao cheiro do quadro e para estimular a aceitação das larvas pelas operárias (Figura 3).

cúpula de cera (B)
No dia da enxertia as cúpulas foram previamente preparadas com aproximadamente 0,5ml de geleia real diluída em água destilada na proporção de 1/1, para posteriormente as larvas ser transferidas.
Após a enxertia, um quadro com 30 larvas (10 em cada posição) foi inserido na colmeia recria, enquanto outro quadro com mais 30 larvas (10 em cada posição) foi mantido em laboratório em um capela, com lâmpadas de 40w e bacias com água, com temperatura entre 28 e 30°Ce umidade entre 60 e 77% e por fim, mais 30 larvas, enxertadas em cúpulas como as demais e alocadas dentro de dois dessecadores, com água no compartimento para sílica, para a manutenção da umidade relativa, sendo esses, acondicionados em uma câmara de incubação (BOD) com controle de temperatura, modelo LT 320 TPF-I, da marca Climatec®, possibilitando maior controle de temperatura e umidade (±34°C e UR 96%) (Figura 5).

Diariamente, as larvas mantidas em laboratório foram avaliadas com auxílio de um microscópio digital para verificar o índice de mortalidade. Essas observações eram feitas num menor espaço de tempo, a fim de evitar exposição das larvas a condições ambientais desfavoráveis.
As larvas vivas eram alimentadas às 08:00h e às 16:00h, com o auxílio de uma espátula, com a mesma solução de geleia real e água destilada, na proporção de 1/1. Para as larvas inseridas na colmeia recria, a observação de aceitação das realeiras pelas larvas e operárias foi feita 72 horas após a colocação do quadro no interior do ninho. O delineamento utilizado foi o inteiramente casualizado com 3 tratamentos e 10 repetições. Os dados obtidos foram digitados em planilhas eletrônicas, analisados descritivamente e expressos em percentuais, utilizando o programa Microsoft Excel.

larvas de laboratório (capela) cristalizadas mortas com 96 horas (C) e larvas da câmara de
incubação (BOD) mortas com 8 dias de vida (D).
RESULTADOS E DISCUSSÕES
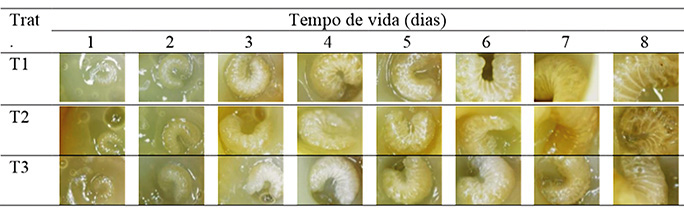
Não foi possível avaliar a relação entre a posição das realeiras sobre as características morfológicas das rainhas, pois nas cinco tentativas, sendo 2 na colmeia recria, 2 na capela e 1 na câmara de incubação (BOD) nenhuma larva sobreviveu mais que 8 dias. As larvas enxertadas, postas na colmeia recria nas diferentes posições foram todas retiradas das cúpulas e transferidas pelas operárias para realeiras construídas nos quadros do ninho (Figura 7A e B). As larvas criadas em laboratório só sobreviveram até o 4º e 8º dia em ambas as posições, na capela (Figura 7C) e na BOD (Figura 7D) respectivamente.
Com relação às características morfológicas, HALAK (2012), encontrou como valores médios de referência para rainhas Apis mellifera, peso à emergência de 215,64 mg, comprimento de abdômen de 11,65 mm e largura de abdômen igual a 5,09 mm. O autor ainda aponta a relação de tais medidas com a prolificidade da rainha e a produtividade da colônia, uma vez que rainhas mais pesadas tendem a possuir maior sistema reprodutivo.
A rejeição de 100% em 72 horas ocorreu tanto para o quadro inicialmente inserido na colmeia matriz para verificar a aceitação por parte das operárias, com larvas sem adição de geleia real, quanto para o quadro porta cúpulas inserido na colmeia recria com adição de geleia real produzida na própria colmeia quanto para adquirida comercialmente. Tais valores diferem consideravelmente daqueles encontrados por ALBARRACÍN et al. (2006) e PEREIRA et al. (2006), que obtiveram, ambos, altos níveis de aceitação de cúpulas trabalhando com abelhas africanizadas em regiões tropicais.
Existem vários fatores que podem influenciar a aceitação de larvas para produção de rainhas por operárias de Apis mellifera, como temperatura, umidade, radiação solar, fluxo de néctar e número de larvas transferidas. (PEREIRA, 2013; TOLEDO, 2012). Além disso, GARCIA et al.(2000)sugere que existe correlação entre coloração e textura das cúpulas com a aceitação destas pelas operárias.Porém esta possibilidade foi descartada por este experimento, uma vez que, as cúpulas foram fabricadas a partir de cera retirada da própria colmeia matriz.
Já as larvas mantidas em laboratório (capela) sem controle preciso de umidade e temperatura morreram todas no 4º dia experimental em todos os tratamentos, devido a cristalização da geleia real (Figura 7D). Após pequenos testes realizados posteriormente, constatou-se que tal cristalização ocorre devido à exposição da geleia real a umidade abaixo de 90%, o que faz com que a mesma perca a umidade e cristalize, matando a larva. Este é provavelmente o principal motivo de vários autores (CRIELSHEIM et al., 2013;KAMAKURA, 2011; HANSER, 1983) recomendarem a utilização de UR superior a 90% para criação em laboratório de larvas de Apis mellifera.
posições de cúpulas
Apesar do controle das condições ambientais das larvas acondicionadas na BOD, ocorreu mortalidade de 100% das mesmas em todos os tratamentos. Os índices diários de mortalidade podem ser observados na tabela 1. Tais resultados diferem daqueles encontrados por KAMAKURA (2011) e HANSER (1983), que trabalhando com produção de rainhas em laboratório, conseguiram índices satisfatórios de sobrevivência (>80%).
diferentes posições de cúpulas
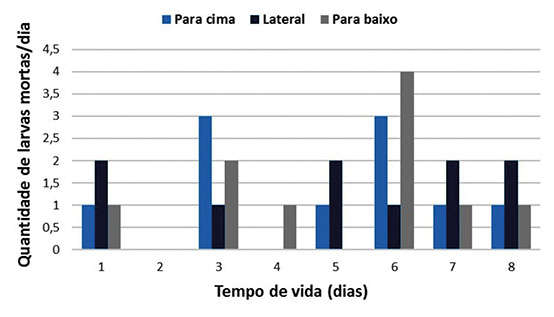
A figura 8 mostra o índice diário de mortalidade das larvas mantidas na câmara incubadora. O número de larvas mortas não segue um padrão, oscilando tanto no tempo quanto entre os tratamentos.
O excesso de umidade e de temperatura na fase de transição de larva para pupa pode ter relação com a mortalidade das larvas. Em uma condição natural dentro da colmeia, o final da fase larval da rainha ocorre entre 6 a 7 dias após a eclosão, nessa hora a célula é operculada e a larva muda de posição, passando a ficar reta, imóvel e não se alimentam.
No 6º e no 7º dia experimentais observou-se principalmente nas larvas que estavam acondicionadas nas cúpulas voltadas para baixo, queda e morte das larvas, possivelmente por estarem mudando de posição, ficando de cabeça para baixo e reta e as cúpulas não estavam operculadas. No sétimo e no oitavo dia as larvas estavam apresentando taquipnéia, ou seja, respiração acelerada, talvez a alta temperatura e umidade nessa fase tenham dificultado a perda de calor pela respiração, e alterado a temperatura corporal, uma vez que as abelhas são insetos homeotérmicos. Nessa linha, TOLEDO (1991) e COSTA (2007) encontraram correlação negativa entre alta umidade e área no ninho ocupada por ovos e larvas de Apis mellifera, indicando que existem limites máximos de umidade que as crias podem suportar.
Como visto na tabela 1, não foram observadas diferenças morfológicas entre os tratamentos no que diz respeito ao desenvolvimento das mesmas, até a fase larval que foi possível de acompanhar. No entanto, vale ressaltar que algumas larvas apresentaram atraso em seu desenvolvimento, visto haver uma grande diferença de tamanho entre larvas de mesma idade. Tal fato ocorreu em todos os tratamentos, indicando que a posição da cúpula não teve efeito sobre o atraso de desenvolvimento das larvas.
Não foi possível avaliar as características morfológicas das abelhas rainhas recém-emergidas Apis melífera nas diferentes posições de cúpula devido ao fato de que nenhuma larva chegou ao estágio final de desenvolvimento.
CONCLUSÕES
A posição da cúpula inserida tanto na colmeia recria quanto nos quadros para criação das larvas em laboratório pode não ter sido o fator crucial para sobrevivência das larvas, sendo necessárias novas pesquisas.
REFERÊNCIAS BIBLIOGRÁFICAS
Albarracín, V. N. et al. Aceitação de larvas de diferentes grupos genéticos de Apis mellifera na produção de abelhas rainhas. Archivos Latinoamericanos de Producción Animal. 2006. Vol. 14.
Boaventura, M. C., SANTOS, G. T. Produção de abelha rainha pelo método da enxertia. Brasília: LK Editora e Comunicação, 2006. 140 p. il. (Coleção Tecnologia Fácil).
Büchler, R. et al. Standard methods for rearing and selection of Apis mellifera queens. Journal of Apicultural Research. 52. 2013.
Costa, F. M .Desenvolvimento de colônias de abelhas Apis melliferaafricanizadas na região de Maringá, Estado do Paraná. Acta Sci. Anim. Sci. Maringá, v. 29, n. 1, p. 101-108, 2007
Crielsheim, K. et al. Standard methods for artificial rearing of Apis mellifera larvae. Journal of Apicultural Research. 52. 2013.
Garcia, R.C.; MALERBO-SOUZA, D.T.; NOGUEIRA-COUTO, R.H. Cúpulas comerciais para produção de geleia real e rainhas em colmeias de abelhas Apis mellifera. Scientia Agrícola, v. 57, n. 2, p. 367-370, 2000.
Halak, A. L. Parâmetros e correlações genéticas e fenotípicas para peso e medidas morfométricas em rainhas Apis mellifera africanizadas.
Hanser, G. (1983) Rearing queen bees in the laboratory. In F Ruttner (Ed.). Queen rearing: Biological basis and technical instruction. Apimondia Publishing House; Bucharest, Romania. pp: 63-81.
Kamakura, M. (2011) Royalactin induces queen differentiation in honey bees. Nature. 473: 478-483. http://dx.doi.org/10.1038/nature10093
Pereira, D. S. et al. Produção de rainhas (Apis mellifera L.), e taxa de fecundação natural em quatro municípios do nordeste brasileiro. Revista Verde, Mossoró – RN, v. 8, n. 2, 2013.
Pereira, F. M. et al. Desenvolvimento de colônias de abelhas com diferentes alimentos proteicos. Pesquisa agropecuária brasileira, Brasília, v.41, n.1, 2006.
Toledo, V.A.A. Desenvolvimento de colmeias híbridas de Apis mellifera e seu comportamento na aceitação e manejo da cera. 1991. Dissertação (Mestrado)–Faculdadede Ciências Agrárias e Veterinárias, Universidade Estadual Paulista, Jaboticabal, 1991.
Toledo, V. A. A.; mouro, G. F.. Produção de geleia real com abelhas africanizadas selecionadas e cárnicas híbridas. R. Bras. Zootec., Viçosa , v. 34, n. 6, Dec. 2005
Toledo, V. A. A. et al. Produção de realeiras em colônias híbridas de Apis mellifera L. e longevidade de rainhas. Gl. Sci. Technol., Rio Verde, v.05, n.02, p.176 – 185. 2012.
Wiese, H. (Org.) Apicultura, Novos Tempos. Porto Alegre: Agropecuária, 2005. 493p

